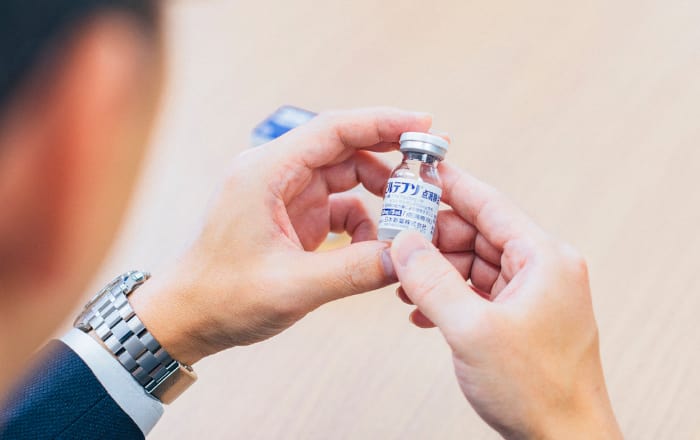
国産初の核酸医薬品
前例のない研究開発「ビルテプソ」に込められた想い


※本記事の所属、役職、内容は取材当時のものです。
日常生活を送っているだけでも、筋肉が壊れやすく、再生が追いつかなくなる指定難病「筋ジストロフィー」。その中でも「デュシェンヌ型筋ジストロフィー(DMD)」は、タンパク質の設計図である遺伝子に変異があり、特定のタンパク質(ジストロフィンタンパク質)が作れず、筋力が低下していく病気です。
日本新薬は2020年、DMD治療剤「ビルテプソ」を発売しました。このくすりにつながる研究が始まったのは、十数年以上も前のこと。長い年月をかけて世に出た「ビルテプソ」は、国産初の核酸医薬品としても注目され、さらにアメリカでも同じ年に発売を迎えることができました。
前例のない先駆け審査指定制度や、日米同時開発、長年にわたる研究開発など、さまざまな困難を乗り越えてきた当時の研究開発のメンバーに集まってもらい、「ビルテプソ」に込めた想いや開発エピソードを語ってもらいました。
「核酸医薬」という、前例のない研究に挑む。


田島
私が入社して間もない1997年、日本新薬は、まだ誰もなし得なかった核酸医薬品の研究に力を注ぐため、茨城県つくば市に「東部創薬研究所」を設立しました。
大崎
ちょうど私が就職活動をしていたタイミングと重なり、つくばに新しい研究所ができるという話を耳にしました。私は生まれも育ちも茨城で、大学院では分子生物学を勉強していましたので、ぜひここで新薬の研究をやってみたいという想いから入社を決意しました。入社後は、希望通りに「東部創薬研究所」に配属。しかし、核酸医薬は当時ほとんど前例のない研究であり、成果が形となって現れるまでにはかなりの年月がかかりました。
渡辺
私は2002年に入社し、核酸医薬の研究に携わってきました。この頃も、なかなか次のステップにつながるような成果がなく、それでもみんな諦めずに研究を続けてきました。そんな中、「デュシェンヌ型筋ジストロフィー」に関する研究が、2009年から始まりました。
「ここで結果を出さなければ、研究の継続は難しいかもしれない」という状況の中、スピード感も求められていたため、あらかじめ綿密なスケジュールを立てて進めていきました。そこで培養細胞を用いてジストロフィン遺伝子のスキッピング活性を指標に見出したのが「ビルテプソ」でした。DMDの患者さんの細胞に「ビルテプソ」を添加したところ、ジストロフィンタンパク質が作られていることが確認でき、道がひらけていったのです。
核酸医薬品とは
DNAやRNAといった遺伝子情報を司る物質「核酸」を用いた医薬品のこと。従来の低分子医薬では狙えなかった分子をターゲットとすることができ、これまで治療が困難だった疾患に対する医薬品の創出が期待されています。
杉本
「ビルテプソ」を次のステップである臨床開発へと進めるためには治験薬が必要になることから、私は原薬のスケールアップ検討に着手しました。核酸医薬品の製造は、経験したことのない仕事でしたので、当時は原薬を数グラムつくるのにも大変苦労しました。
CMCチームや関連部門のメンバー、メーカーのみなさんと何度も話し合いを重ね、課題を見つけては改善していくことを繰り返しました。はじめは途方もないゴールに感じていましたが、階段を一段一段上がるように生産量を徐々に伸ばしていき、なんとか量産にたどり着くことができました。


一例一例のデータを、みんなで一丸となって積み重ねる。
田島
一般的に、患者さんの数が5万人以下の疾患を「希少疾患」というのですが、日本国内のDMDの患者さんはおよそ5千名。DMDはとりわけ希少な疾患で、有効な治療法は見つかっていない状況でした。治療に携わる先生方も「なんとか治したい」という強い想いを長年抱かれていて、本当に惜しみない協力をしていただきました。そして、販売承認を得るためには、治験においてより多くの患者さんのデータを取得し、有効性や安全性を確認する必要があるため、「日米同時開発」という、日本新薬にとって初めてのプロジェクトが動き出しました。
大崎
私は、アメリカでの「ビルテプソ」開発に携わるために日本新薬のグループ会社であるNS Pharmaに出向し、オフィスのあるニュージャージーに移り住みました。出向当初のNS PharmaのR&D部門の人数は、社長兼部長を含めて4名。治験を担当する医師や、治験を代行する企業であるCRO、コンサルタントなど、さまざまな外部パートナーと連携しながら開発を進めていきました。
田島
最終的に治験に参加いただいた患者さんは、日本で26例、アメリカで16例の、合計42例でした。その一例一例を、治験を担当する先生方とともに、一丸となって積み上げてきました。DMDは希少疾患であり、かつ遺伝子の変異にもタイプがあり、治験の対象となる年齢に制限を設けていたため、対象となる患者さんひとりに出会うことがそもそも困難でした。
全国の基幹病院に直接お伺いし、情報を提供していただきながら進めていきました。一例一例のデータが、DMDの患者さんの未来につながっている。そんな想いを先生たちと共有しながら、開発を進めてきました。
大崎
開発当初NS Pharmaの名前自体ほとんど知られていないアメリカで、16例のデータを集めるまでにも長く険しい道のりがありました。まずは病院の先生方に「ビルテプソ」のことを知っていただくために、粘り強く説明を行いました。するとやがて、熱心な協力者になっていただける先生が少しずつ現れて、自分の病院に患者さんがいない場合でも、近くの病院を回ってくださったこともありました。
治験が進んで実際に試験結果としてデータが出てきた時、DMDの患者さんがつくれなかったタンパク質がそこにはっきり現れていて、それを見た関係者たちの間で、承認取得に向けたこれまでにない活発な意見が飛び交うようになりました。共通のゴールに向かってチームが一つになって動き出した時は、胸が熱くなりました。
渡辺
日米で開発を進める中で、臨床試験でも効果がみられ、段階を経るごとに研究者としての達成感も強まっていきました。
「先駆け審査指定制度」に採択。一日でも早く、くすりを届けるために。
田島
ビルテプソは、国産初の核酸医薬品であるだけでなく、日本で初めて「先駆け審査指定制度」の対象品目の一つになりました。
先駆け審査指定制度とは
ビルテプソの開発当時に設けられた、日本国内の革新的な医薬品を指定し、世界に先駆けて早期実用化を目指す制度。薬事承認に関する相談や審査で優先的な取り扱いを受けることで、承認審査の期間を大幅な短縮が可能になります。(2020年より、「先駆的医薬品指定制度」として法制化。)
杉本
原薬開発に目処がつき始めた頃、研開企画部への異動の話が舞い込んできました。まったく経験したことのない業務でしたが、引きつづき「ビルテプソ」に関わり続けることができるという喜びもあり、開発全体を管理するプロジェクトマネージャーとして、新たな仕事に打ち込みました。
プロジェクトを推進するためには、目標に向かってお互いに協力し合う必要があり、チームづくりが大切になります。ビルテプソの開発に関わるメンバーには、すでに互いに協力して物事を進める土壌が育まれていたため、周りからの心強いサポートに支えられながら、目的達成に向けて最善を尽くしてきました。「ビルテプソ」の早期承認に向けて、田島さんや関係部門の方々とはPMDA(医薬品医療機器総合機構)に幾度となく足を運んで協議をしましたね。
田島
「条件付き早期承認品目」に指定してもらうために、「ビルテプソ」の安全性や有効性について粘り強く訴えました。一日でも早く患者さんに薬を届けたいという気持ちでした。


条件付き早期承認制度とは
患者数が少ないなどの理由でP3試験などの臨床試験を行うことが難しい医薬品について、発売後に安全性・有効性を評価することを条件に承認する制度です。(2020年より、「条件付き早期承認制度」として法制化。)
杉本
先駆け審査指定制度や条件付き早期承認制度を活用したことで、異例ともいえるスピードで開発を進めることができました。
舞台は、グローバル。さらなる新薬開発に挑み続ける。
田島
「ビルテプソ」は、部署の垣根を大きく超え、本当に多くのみなさんの協力を得て、患者さんのもとへ届けることができました。日本新薬は決して規模の大きな会社ではありません。しかしその分、ひとりに任される仕事の領域がとても広く、臨床開発の場合だと、治験計画の立案から承認取得まで、「自分がこの薬に携わったのだ」と胸を張って言えるまで、ひとつの薬と向き合うことができます。
杉本
「デュシェンヌ型筋ジストロフィー」は、主に男児が発症する希少な疾患です。その新しい治療法となり得る選択肢を、患者さんとご家族に届けることができました。日本新薬は、このような画期的な薬をつくる研究開発力がありますし、新たなことに取り組むチャレンジ精神があります。
私自身のことをふり返ると、原薬のプロセス研究をしていた時には、プロジェクトマネージャーとして開発に関わるなんて想像もつきませんでした。さまざまなキャリアの選択肢があり、チャレンジを重ねるたびに、次なる成長のステップを示してくれる会社だと考えています。


大崎
「ビルテプソ」の承認、販売をきっかけに、アメリカでもDMDの患者さん、ご家族、患者支援団体の中で日本新薬、NS Pharmaの名前が徐々に知られてきていると感じます。世界にはまだまだ薬を待っている患者さんや、そのご家族がいます。日本新薬のグローバル開発・展開は始まったばかりなので、これから入社してくる方には、一からいろいろなことにチャレンジできる環境があります。
渡辺
国産初のアンチセンス医薬品を開発しているように、これまで経験がなかったような新しい薬剤についても、さまざまな専門性を持った人たちが協力しながら研究・開発を進めています。
創薬研究所では、その起点となる化合物をつくるところや、薬効、物性、安全性などの評価など、きわめて初期の段階から関わっていくことができます。こうした仕事に魅力を感じてか、いま東部創薬研究所には若手研究者たちが続々と入社していて、エネルギーに満ち溢れています。ここでの研究は、ますます面白くなっていくだろうと感じています。
田島
「ビルテプソ」は日本新薬にとって、初めて日米同時開発に成功した新薬でもあります。ここまでの道のりは決して楽ではありませんでしたが、同じ年に日米で発売を迎えられたことは、私たちにとって、今後につながる大きな一歩になったと感じています。
グローバルを舞台にした日本新薬の挑戦は、まだ始まったばかりですから、苦労も喜びも分かち会える仲間たちと一緒に、道なき道をさらに切り拓いていきたいと考えています。