医薬品はヒトの生命や健康に重大な影響を与え得るため、極めて高い公益性があります。
そのため、医薬品は厳しい法規制のもと管理されており、新薬の開発には長い時間と多額な費用が必要となります。
医薬品の種類
医薬品は医療用医薬品と一般用医薬品に分かれており、医療用医薬品は先発医薬品と後発医薬品(ジェネリック医薬品)に分かれています。日本新薬は研究開発型の先発医薬品メーカーです。
| 医薬品 | 医療用医薬品 (医師の処方箋に基づき薬局で調剤される医薬品) |
先発医薬品(新薬) (新しい成分の有効性と安全性が確認された後、国の承認を得て発売される医薬品) |
|---|---|---|
| 後発医薬品(ジェネリック医薬品) (先発医薬品の特許期間満了後に先発医薬品と同じ有効成分で製造・販売される医薬品) |
||
| 一般用医薬品 (OTC) |
薬局などで市販されており直接購入できる医薬品 |
医薬品市場
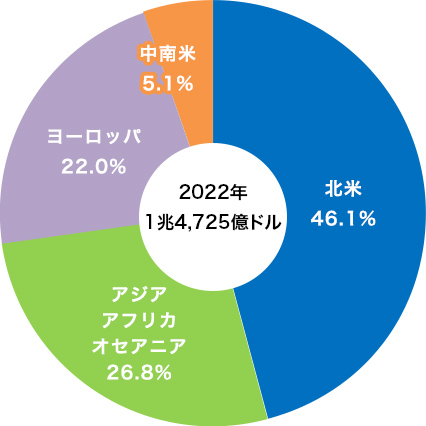
医薬品の市場規模は、世界で約193兆円、日本で約9兆円※となっています。
日本は、米国、中国に次ぐ世界第3位の市場です。(1ドル=131.50円で換算)
※日本製薬工業協会 DATA BOOK 2024
出所:厚生労働省「薬事工業生産動態統計年報」
出典:日本製薬工業協会 DATABOOK2024
医薬品の国内市場は、社会保障費の増加を受け、後発医薬品の使用促進策の強化を進めるなど厳しい状況にありますが、日本新薬は、画期的な先発医薬品の研究開発を続けるとともに、グローバル事業の展開を進めています。
例えば、自社創薬品の肺動脈性肺高血圧症治療剤「ウプトラビ」は、グローバルパートナーであるジョンソン・エンド・ジョンソン社が世界中で営業活動を行っています。また、自社創薬品のデュシェンヌ型筋ジストロフィー治療剤「ビルテプソ」は米国で自社販売を開始しています。
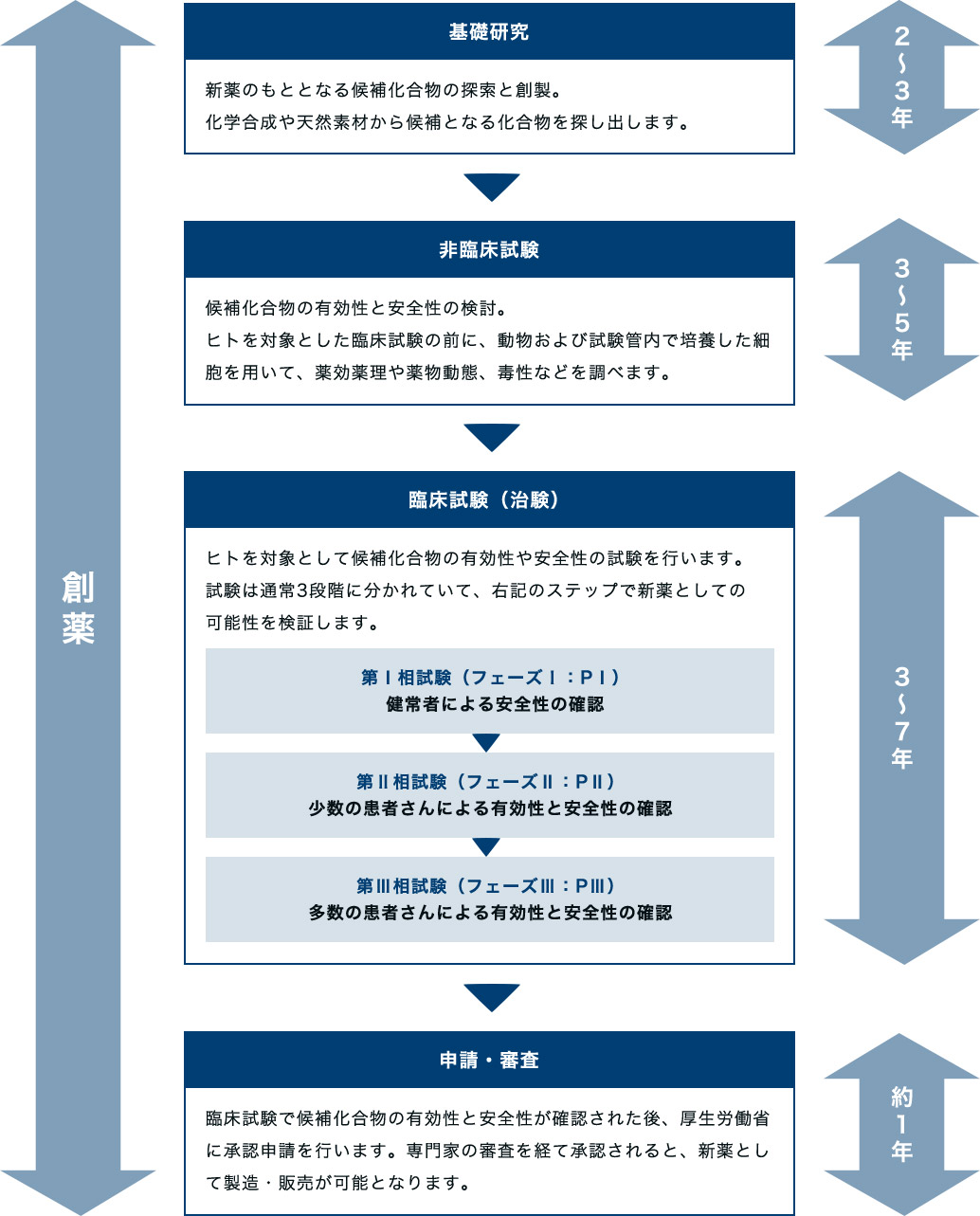
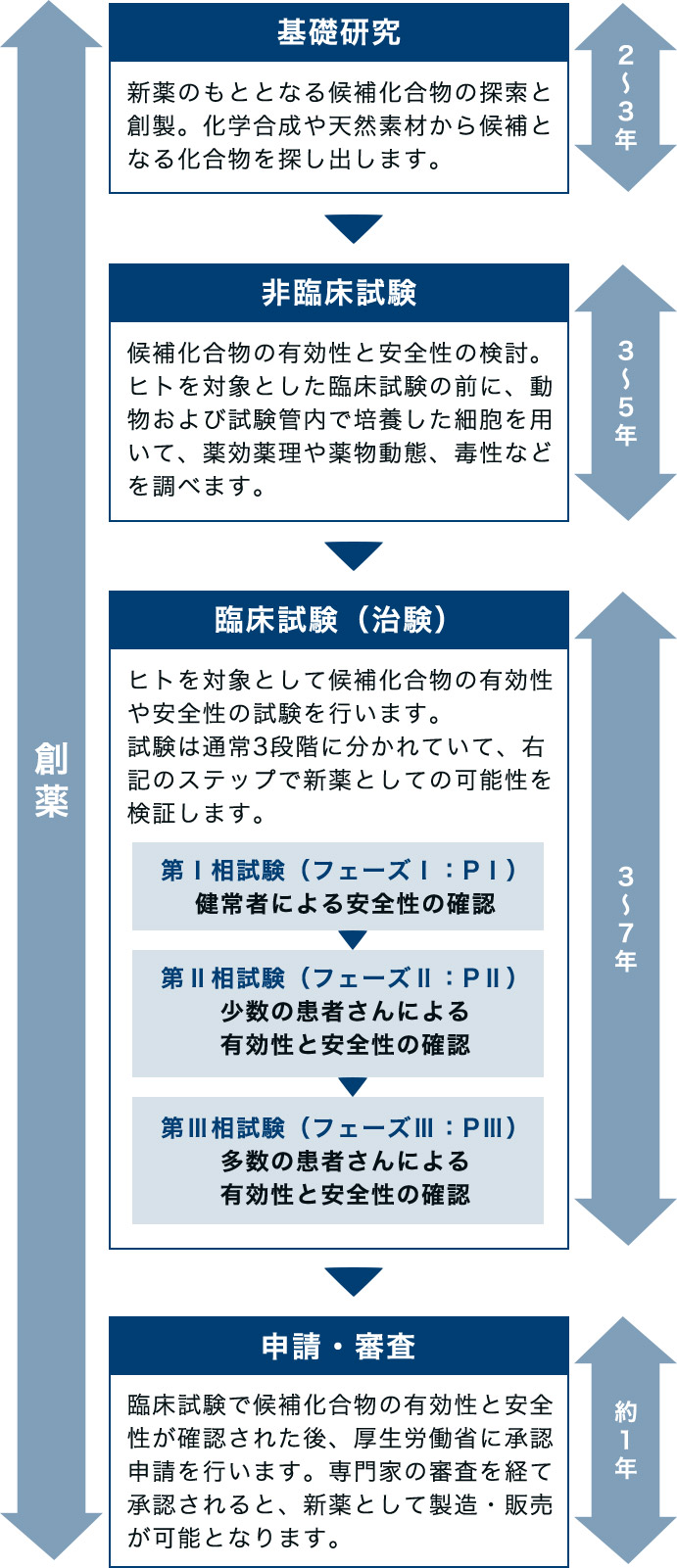
医薬品ができるまで
日本での新薬発売の成功確率は、約3万分の1ときわめて低く、ほとんどの候補化合物は、途中で開発が中断される厳しい世界です。
新薬の開発のプロセスは、基礎研究・非臨床試験・臨床試験に分かれています。臨床試験ののち、厚生労働大臣の承認を受け、初めて新薬として製造・販売が可能となります。新薬の開発には長い時間がかかることで知られており、多くの場合、上市まで10年以上の時間がかかります。
研究開発費
医薬品業界は、他の産業に比べて研究開発費の割合が高いことで知られています。優れた新薬を生み出すためには、継続的な投資が不可欠です。
日本新薬は、第七次5ヵ年中期経営計画(2024年度~2028年度)の取り組みの一つに「サステナブルな成長に向けた財務戦略」を掲げ、5年間で総額約1,900億円の研究開発投資を行う予定です。
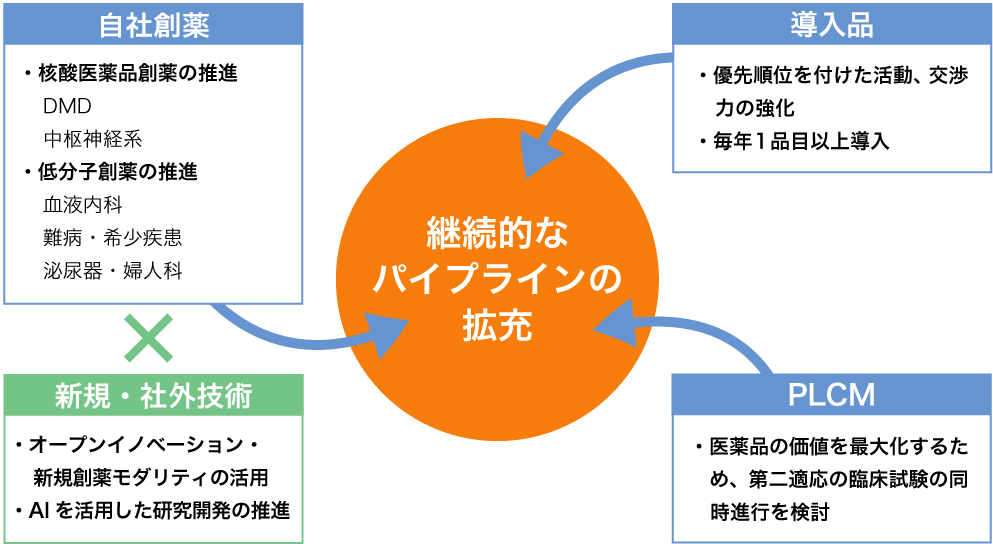
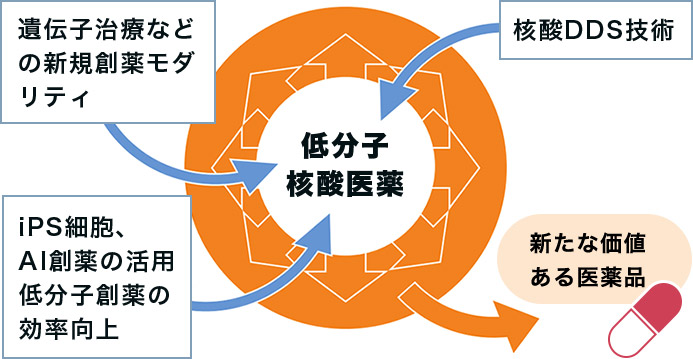
核酸・低分子創薬を中心に、グローバル展開を狙える疾患・領域に経営資源を集中させています。自社創薬、導入、PLCM(プロダクト・ライフサイクル・マネジメント)の3本柱で年平均 2品目以上の新製品上市を予定しており、研究開発パイプラインを充実させていきます。







